高中化学常考的100个知识点总结,学霸必备!(3)
时间:2019-01-18 23:08 来源:百度新闻 作者:巧天工 点击:次
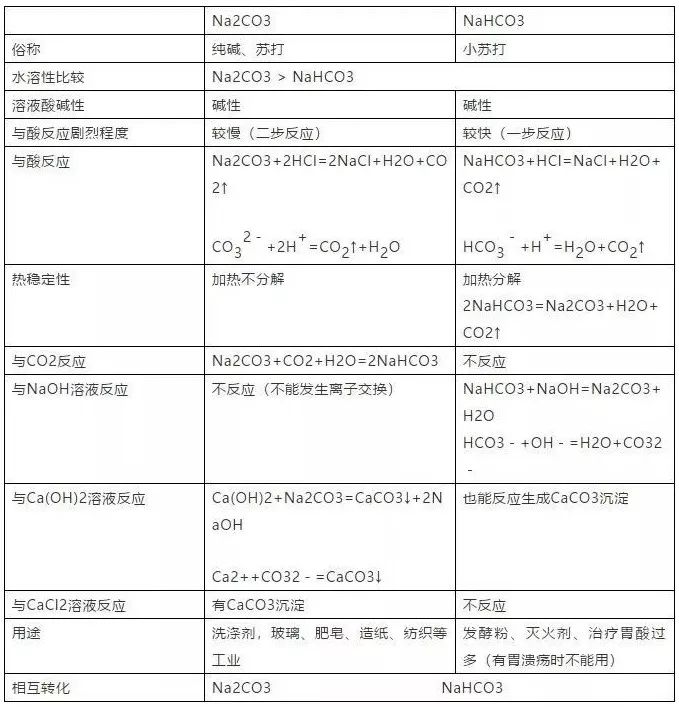
24、铝与某些金属氧化物的反应(如V、Cr、Mn、Fe的氧化物)叫做铝热反应Fe2O3+2Al == 2Fe+Al2O3,Al 和 Fe2O3的混合物叫做铝热剂。利用铝热反应焊接钢轨。 25、铁的特质 (1)单质铁的物理性质:铁片是银白色的,铁粉呈黑色,纯铁不易生锈,但生铁(含碳杂质的铁)在潮湿的空气中易生锈。(原因:形成了铁碳原电池。铁锈的主要成分是Fe2O3)。 26、铁与氧气反应: 3Fe+2O2===Fe3O4(现象:剧烈燃烧,火星四射,生成黑色的固体) 27、与非氧化性酸反应: Fe+2HCl=FeCl2+H2↑ (Fe+2H+=Fe2++H2↑) 常温下铝、铁遇浓硫酸或浓硝酸钝化。加热能反应但无氢气放出。 28、与盐溶液反应: Fe+CuSO4=FeSO4+Cu(Fe+Cu2+=Fe2++Cu) 29、与水蒸气反应: 3Fe+4H2O(g)==Fe3O4+4H2 30、氧化物 (1)Al2O3的性质:氧化铝是一种白色难溶物,其熔点很高,可用来制造耐火材料如坩锅、耐火管、耐高温的实验仪器等。 Al2O3是两性氧化物:既能与强酸反应,又能与强碱反应: Al2O3+ 6HCl =2AlCl3 + 3H2O (Al2O3+6H+=2Al3++3H2O ) Al2O3+ 2NaOH == 2NaAlO2 +H2O(Al2O3+2OH-=2AlO2-+H2O) (2)铁的氧化物的性质:FeO、Fe2O3都为碱性氧化物,能与强酸反应生成盐和水。 FeO+2HCl =FeCl2+H2O Fe2O3+6HCl=2FeCl3+3H2O 31、氢氧化物 (1)氢氧化铝 Al(OH)3 ①Al(OH)3是两性氢氧化物,在常温下它既能与强酸,又能与强碱反应: Al(OH)3+3HCl=AlCl3+3H2O(Al(OH)3+3H+=Al3++3H2O) Al(OH)3+NaOH=NaAlO2+2H2O(Al(OH)3+OH-=AlO2-+2H2O) ②Al(OH)3受热易分解成Al2O3:2Al(OH)3==Al2O3+3H2O(规律:不溶性碱受热均会分解) ③Al(OH)3的制备:实验室用可溶性铝盐和氨水反应来制备Al(OH)3 Al2(SO4)3+6NH3·H2O=2 Al(OH)3↓+3(NH4)2SO4 (Al3++3NH3·H2O=Al(OH)3↓+3NH4+) 因为强碱(如NaOH)易与Al(OH)3反应,所以实验室不用强碱制备Al(OH)3,而用氨水。 (2)铁的氢氧化物:氢氧化亚铁Fe(OH)2(白色)和氢氧化铁Fe(OH)3(红褐色) ①都能与酸反应生成盐和水: Fe(OH)2+2HCl=FeCl2+2H2O(Fe(OH)2+2H+=Fe2++2H2O) Fe(OH)3+3HCl=FeCl3+3H2O(Fe(OH)3 + 3H+ = Fe3+ + 3H2O) ②Fe(OH)2可以被空气中的氧气氧化成Fe(OH)3 4Fe(OH)2+O2+2H2O=4Fe(OH)3(现象:白色沉淀→灰绿色→红褐色) ③Fe(OH)3受热易分解生成Fe2O3:2Fe(OH)3==Fe2O3+3H2O (3)氢氧化钠NaOH:俗称烧碱、火碱、苛性钠,易潮解,有强腐蚀性,具有碱的通性。 32、盐: (1)铁盐(铁为+3价)、亚铁盐(铁为+2价)的性质: ①铁盐(铁为+3价)具有氧化性,可以被还原剂(如铁、铜等)还原成亚铁盐:2FeCl3+Fe=3FeCl2( 2Fe3++Fe=3Fe2+ )(价态归中规律) 2FeCl3+Cu=2FeCl2+CuCl2( 2Fe3++Cu=2Fe2++Cu2+)(制印刷电路板的反应原理) 亚铁盐(铁为+2价)具有还原性,能被氧化剂(如氯气、氧气、硝酸等)氧化成铁盐:2FeCl2+Cl2=2FeCl3 ( 2Fe2++Cl2=2Fe3++2Cl- ) ②Fe3+离子的检验: a.溶液呈黄色; b.加入KSCN(硫氰化钾)溶液变红色; c.加入NaOH溶液反应生成红褐色沉淀[Fe(OH)3]。 Fe2+离子的检验: a.溶液呈浅绿色; b.先在溶液中加入KSCN溶液,不变色,再加入氯水,溶液变红色; c.加入NaOH溶液反应先生成白色沉淀,迅速变成灰绿色沉淀,最后变成红褐色沉淀。 (2)钠盐:Na2CO3与NaHCO3的性质比较
33、焰色反应 (1)定义:金属或它们的化合物在灼烧时使火焰呈现特殊颜色的性质。 (2)操作步骤:铂丝(或铁丝)用盐酸浸洗后灼烧至无色,沾取试样(单质、化合物、气、液、固均可)在火焰上灼烧,观察颜色。 (3)重要元素的焰色:钠元素黄色、 钾元素紫色(透过蓝色的钴玻璃观察,以排除钠的焰色的干扰) 焰色反应属物理变化。与元素存在状态(单质、化合物)、物质的聚集状态(气、液、固)等无关,只有少数金属元素有焰色反应。 34、硅及其化合物 Si 硅元素在地壳中的含量排第二,在自然界中没有游离态的硅,只有以化合态存在的硅,常见的是二氧化硅、硅酸盐等。 硅的原子结构示意图为,硅元素位于元素周期表第三周期第ⅣA族,硅原子最外层有4个电子,既不易失去电子又不易得到电子,主要形成四价的化合物。 35、单质硅(Si): (1)物理性质: 有金属光泽的灰黑色固体,熔点高,硬度大。 (2)化学性质: ①常温下化学性质不活泼,只能跟F2、HF和NaOH溶液反应。 Si+2F2=SiF4 Si+4HF=SiF4↑+2H2↑ Si+2NaOH+H2O=Na2SiO3+2H2↑ ②在高温条件下,单质硅能与O2和Cl2等非金属单质反应。 (3)用途:太阳能电池、计算机芯片以及半导体材料等。 (4)硅的制备:工业上,用C在高温下还原SiO2可制得粗硅。 SiO2+2C=Si(粗)+2CO↑ Si(粗)+2Cl2=SiCl4 SiCl4+2H2=Si(纯)+4HCl 36、二氧化硅(SiO2): (1)SiO2的空间结构:立体网状结构,SiO2直接由原子构成,不存在单个SiO2分子。 (2)物理性质:熔点高,硬度大,不溶于水。 (3)化学性质:SiO2常温下化学性质很不活泼,不与水、酸反应(氢氟酸除外),能与强碱溶液、氢氟酸反应,高温条件下可以与碱性氧化物反应: ①与强碱反应:SiO2+2NaOH=Na2SiO3+H2O(生成的硅酸钠具有粘性,所以不能用带磨口玻璃塞试剂瓶存放NaOH溶液和Na2SiO3溶液,避免Na2SiO3将瓶塞和试剂瓶粘住,打不开,应用橡皮塞)。 ②与氢氟酸反应[SiO2的特性]:SiO2+4HF=SiF4↑+2H2O(利用此反应,氢氟酸能雕刻玻璃;氢氟酸不能用玻璃试剂瓶存放,应用塑料瓶)。 ③高温下与碱性氧化物反应:SiO2+CaOCaSiO3 (4)用途:光导纤维、玛瑙饰物、石英坩埚、水晶镜片、石英钟、仪器轴承、玻璃和建筑材料等。 37、硅酸(H2SiO3): (1)物理性质:不溶于水的白色胶状物,能形成硅胶,吸附水分能力强。 (2)化学性质:H2SiO3是一种弱酸,酸性比碳酸还要弱,其酸酐为SiO2,但SiO2不溶于水,故不能直接由SiO2溶于水制得,而用可溶性硅酸盐与酸反应制取:(强酸制弱酸原理) Na2SiO3+2HCl=2NaCl+H2SiO3↓ Na2SiO3+CO2+H2O=H2SiO3↓+Na2CO3(此方程式证明酸性:H2SiO3<H2CO3) (3)用途:硅胶作干燥剂、催化剂的载体。 38、硅酸盐 (责任编辑:波少) |