高中化学常考的100个知识点总结,学霸必备!(4)
时间:2019-01-18 23:08 来源:百度新闻 作者:巧天工 点击:次
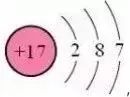
硅酸盐:硅酸盐是由硅、氧、金属元素组成的化合物的总称。硅酸盐种类很多,大多数难溶于水,最常见的可溶性硅酸盐是Na2SiO3,Na2SiO3的水溶液俗称水玻璃,又称泡花碱,是一种无色粘稠的液体,可以作黏胶剂和木材防火剂。硅酸钠水溶液久置在空气中容易变质: Na2SiO3+CO2+H2O=Na2CO3+H2SiO3↓(有白色沉淀生成) 传统硅酸盐工业三大产品有:玻璃、陶瓷、水泥。 硅酸盐由于组成比较复杂,常用氧化物的形式表示:活泼金属氧化物→较活泼金属氧化物→二氧化硅→水。氧化物前系数配置原则:除氧元素外,其他元素按配置前后原子个数守恒原则配置系数。 硅酸钠:Na2SiO3 Na2O·SiO2 硅酸钙:CaSiO3 CaO·SiO2 高岭石:Al2(Si2O5)(OH)4 Al2O3·2SiO2·2H2O 正长石:KAlSiO3不能写成K2O· Al2O3·3SiO2,应写成K2O·Al2O3·6SiO2 :氯及其化合物 39、氯原子结构示意图为:
氯元素位于元素周期表中第三周期第ⅦA族,氯原子最外电子层上有7个电子,在化学反应中很容易得到1个电子形成 Cl-,化学性质活泼,在自然界中没游离态的氯,氯只以化合态存在(主要以氯化物和氯酸盐)。 40、氯气(Cl2): (1)物理性质:黄绿色有刺激性气味有毒的气体,密度比空气大,易液化成液氯,易溶于水。(氯气收集方法—向上排空气法或者排饱和食盐水;液氯为纯净物) (2)化学性质:氯气化学性质非常活泼,很容易得到电子,作强氧化剂,能与金属、非金属、水以及碱反应。 ①与金属反应(将金属氧化成最高正价) Na+Cl2===点燃2NaCl Cu+Cl2===点燃CuCl2 2Fe+3Cl2===点燃2FeCl3(氯气与金属铁反应只生成FeCl3,而不生成FeCl2。) (思考:怎样制备FeCl2?Fe+2HCl=FeCl2+H2↑,铁跟盐酸反应生成FeCl2,而铁跟氯气反应生成FeCl3,这说明Cl2的氧化性强于盐酸,是强氧化剂。) ②与非金属反应 Cl2+H2 ===点燃 2HCl(氢气在氯气中燃烧现象:安静地燃烧,发出苍白色火焰) 将H2和Cl2混合后在点燃或光照条件下发生爆炸。 燃烧:所有发光发热的剧烈化学反应都叫做燃烧,不一定要有氧气参加。 ③Cl2与水反应 Cl2+H2O=HCl+HClO 离子方程式:Cl2+H2O=H++Cl—+HClO 将氯气溶于水得到氯水(浅黄绿色),氯水含多种微粒,其中有H2O、Cl2、HClO、Cl-、H+、OH-(极少量,水微弱电离出来的)。 氯水的性质取决于其组成的微粒: (1)强氧化性:Cl2是新制氯水的主要成分,实验室常用氯水代替氯气,如氯水中的氯气能与KI,KBr、FeCl2、SO2、Na2SO3等物质反应。 (2)漂白、消毒性:氯水中的Cl2和HClO均有强氧化性,一般在应用其漂白和消毒时,应考虑HClO,HClO的强氧化性将有色物质氧化成无色物质,不可逆。 (3)酸性:氯水中含有HCl和HClO,故可被NaOH中和,盐酸还可与NaHCO3,CaCO3等反应。 (4)不稳定性:HClO不稳定光照易分解。,因此久置氯水(浅黄绿色)会变成稀盐酸(无色)失去漂白性。 (5)沉淀反应:加入AgNO3溶液有白色沉淀生成(氯水中有Cl-)。自来水也用氯水杀菌消毒,所以用自来水配制以下溶液如KI、 KBr、FeCl2、Na2SO3、Na2CO3、NaHCO3、AgNO3、NaOH等溶液会变质 ④Cl2与碱液反应: 与NaOH反应:Cl2+2NaOH=NaCl+NaClO+H2O(Cl2+2OH-=Cl-+ClO-+H2O) 与Ca(OH)2溶液反应:2Cl2+2Ca(OH)2=Ca(ClO)2+CaCl2+2H2O 此反应用来制漂白粉,漂白粉的主要成分为Ca(ClO)2和CaCl2,有效成分为Ca(ClO)2。 (责任编辑:波少) |